Quando le piante ci parlano ci lanciano dei segnali a volte sfumati e a volte eclatanti circa lo stato di sofferenza per la carenza o l’ eccesso di uno o più nutrienti o attraverso una crescita rigogliosa e colori intensi.
Riconoscere questi segnali ci aiuta a correggere la fertilizzazione.

Pertanto passiamo in rassegna i singoli nutrienti principali, sia i macro che i micro elementi, evidenziando cosa comporta ognuno di essi e come reagisce la pianta in caso di una carenza o di un eccesso.
Carbonio (C) – Il carbonio è l’ elemento chimico senza il quale nessuna forma vivente potrebbe esistere. Esso forma insieme all’ idrogeno le strutture di base di tutte le sostanze organiche. La fonte di carbonio per le piante è rappresentata essenzialmente dalla CO2 che viene assorbita dalle foglie. La CO2 solubilizza parzialmente in acqua in base alla temperatura del liquido ed alla pressione esercitata dall’ atmosfera sulla superficie. Esiste un equilibrio costante tra le molecole di gas che entrano in acqua con quelle che ne escono. Inoltre una piccola parte viene prodotta direttamente in acquario a seguito della respirazione cellulare degli animali, dei batteri e delle piante nella fase notturna. Se per alcune piante questa quantità di CO2 può risultare sufficiente per molte altre, soprattutto quelle a crescita veloce e per varietà “esigenti”, la CO2 è quasi sempre insufficiente. Grazie a questo gas il carbonio assorbito tramite le foglie viene utilizzato dalle piante per formare attraverso complesse reazioni le sostanze energetiche (amidi) e quelle plastiche (cellulosa). Esse vengono prodotte senza sosta quindi sia nella fase attiva della fotosintesi (luce) che in quella oscura (buio). Se la CO2 si rivela indispensabile per le piante più esigenti è bene sapere che anche quelle meno esigenti ne traggono un grande vantaggio in termini di crescita. Una bassa concentrazione di CO2 comporta una riduzione della crescita delle piante, le foglie si presentano più piccole e spesso gli internodi si allungano. Molte piante rispondono ad una carenza di CO2 avviando un processo energeticamente molto dispendioso per loro consistente nel produrre esse stesse l’ anidride carbonica attraverso la decalcificazione biogena. Le lamine fogliari superiori ed inferiori diventano un intenso laboratorio per produrre la CO2 utilizzando l’ idrogenocarbonato (HCO3–) presente in acqua. Ciò comporta un sottile deposito calcareo sulla pagina superiore della foglia facilmente visibile sulla elodea densa che è una delle specie più attive da questo punto di vista. Quindi l’ uso della CO2 in acquario è sempre raccomandato.
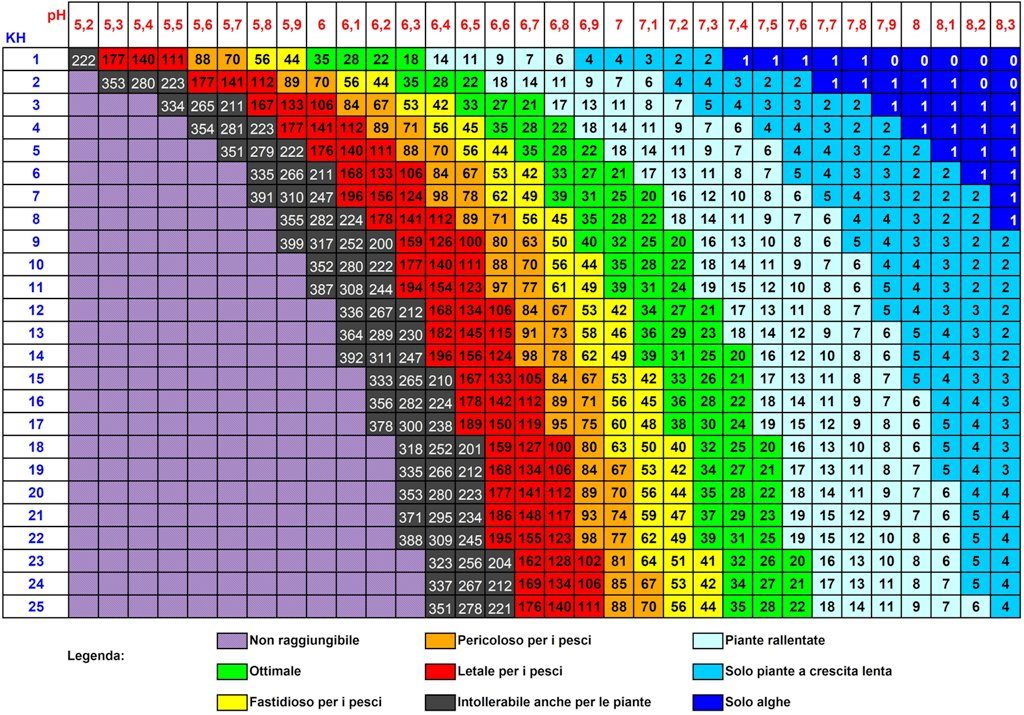
Azoto (N) – Esso costituisce uno dei tre macro elementi fondamentali e può essere somministrato alle piante sia sotto forma inorganica (ammonio e nitrato) che organica (urea come fonte di azoto che deve essere prima trasformata in composto inorganico). Una parte di tutti questi composti vengono prodotti in acquario dal metabolismo dei pesci e di altri animali e dal catabolismo di feci, foglie morte ed eccesso di cibo. Non entro nel merito di questi processi che troviamo ben descritti nel ciclo dell’ azoto di cui rimando la lettura cliccando sul seguente link (https://acquariofili.com/ciclo-azotato/). A differenza del nitrato (NO3–) l’ ammonio (NH4+) viene assorbito con più facilità in quanto l’ assorbimento dei NO3– richiede alle piante uno sforzo in termini di energia maggiore dovendolo trasformare in NH4+ . Poiché l’ NH4+ è in equilibrio in acqua con l’ ammoniaca (NH3) la cui tossicità è nota a livello delle mucose e delle branche è bene evitare che il pH sia superiore a 7,5 non solo quando utilizziamo fertilizzanti contenenti ammonio ma anche nella normale conduzione della vasca. La reazione di equilibrio NH3 + H2O <=> NH4+ + OH– in ambiente acido è tutta spostata verso destra, diversamente l’ equilibrio si sposta verso sinistra in ambiente alcalino e la concentrazione di ammonio si riduce a favore di quella dell’ ammoniaca. Tenete presente che l’ ammoniaca aumenta di ben quattro volte la sua concentrazione quando il pH passa da 7.0 a 7.5 mentre la sua DL50 (dose letale sul 50% dei soggetti) aumenta di ben 5 volte. La presenza di ammonio è fortemente condizionata dal grado di maturazione del filtraggio biologico. Più questo è maturo in termini di colonie minore sarà la sua presenza (vedi ciclo azotato). L’ ammonio è altrettanto assorbito velocemente dalle alghe ed è questa una delle cause maggiori di esplosioni di alghe filamentose. Acquari poco maturi e poco piantumati sono più soggetti alla presenza di queste alghe.
- Carenza: le piante assumo un colore tendente al verde pallido sino ad arrivare al giallo soprattutto nelle foglie più vecchie che sono le prime a morire. Le nuove foglie o quelle apicali per le piante a stelo invece tendono a restare piccole e a volte assumono un colore rosso bruno, tutta la pianta rallenta la sua crescita. Questa carenza spesso è accompagnata dalla comparsa di alghe verdi filamentose in particolare quelle a pelliccia o a peli diradati. L’ azoto pur essendo un elemento mobile (la pianta lo trasferisce sulle parti apicali a discapito delle foglie basali) non viene spostato così velocemente come avviene per il potassio. Le concentrazioni consigliate di NO3– vanno da 5 a 10 mg/litro.
- Eccesso: l’ azoto è così ben tollerato dalle piante che prima di vedere un eccesso tale da provocare danni vi troverete la vasca stracolma di alghe e di pesci morti.
Potassio (K) – E’ il re degli elementi mobili per la velocità con cui la pianta lo trasferisce verso la zona apicale in caso di necessità.
- Carenza: il K è in assoluto il macro elemento maggiormente carente negli acquari perché mentre l’ azoto ed il fosforo sono prodotti in vasca a seguito dei processi metabolici e catabolici, questo macro elemento può essere solo introdotto dall’ esterno attraverso la fertilizzazione. E’ bene sapere che le acque di rete per chi le usa in acquario hanno concentrazioni bassissime di K. Un altro aspetto importante è che una sua carenza riduce l’ assorbimento dell’ azoto. Poiché è mobilizzato rapidamente dalle piante i primi sintomi compaiono sulle foglie più basse. Come già visto per la carenza di azoto le foglie inferiori possono ingiallire e mostrare una crescita ridotta. Quasi sempre compaiono sulle foglie larghe anche dei piccoli puntini neri che si trasformano nel tempo in fori i cui margini diventano gialli o neri a seguito di necrosi del tessuto. Altre conseguenze sono il blocco della ramificazione ed il fusto che può assumere un aspetto di consistenza gommosa. Le concentrazioni del K consigliate vanno da 10 a 20 mg/litro.
- Eccesso: Questo macro è talmente ben tollerato da tutto l’ ambiente acquatico che vedere un eccesso è quasi impossibile. Ci dovreste mettere anima e cuore, svuotare un flacone intero per creare un eccesso di K mentre è molto facile avere gli effetti di una carenza.
Fosforo (P) – Introdotto nelle fertilizzazioni come fosfato (PO4–) questo macro elemento rientra in molti processi biologici. Spesso lo ritroviamo in vasca come per l’ azoto quale prodotto finale dei processi metabolici e catabolici per cui non sempre è necessario integrarlo ma guai a farlo mancare.
- Carenza: i segnali più evidenti sono il forte rallentamento della crescita, la parte apicale delle piante a stelo resta piccola. Questo effetto lo vediamo soprattutto nelle piante a sviluppo veloce. Inoltre la sua carenza può bloccare l’ assorbimento di altri nutrienti come il ferro o il potassio. Un altro segnale di carenza da P l’ abbiamo non dalle piante ma dalla comparsa sui vetri ma anche sulle rocce e sulle foglie delle GSA (green spot algue) di cui potete leggere info e modalità di eliminazione collegandovi al seguente link (https://acquariofili.com/conoscere-le-alghe/8/). Le concentrazioni di PO4– consigliate vanno da 0,1 a 1,0 mg/litro.
- Eccesso: E’ raccomandabile non superare la concentrazione di 1,0 mg/litro anche se in realtà non ci sono problemi per i pesci che tollerano concentrazioni molto più alte. Piante come il myriophyllum crescono meglio con concentrazioni di 2,0 mg/litro di PO4– . L’ effetto di concentrazioni alte di fosfato si manifestano con la comparsa delle BBA (https://acquariofili.com/conoscere-le-alghe/3/) ma il fosfato non è il solo responsabile per la comparsa di queste alghe. Altra conseguenza di un eccesso di P è la sua interferenza nell’ assorbimento del ferro.
Magnesio (Mg) – Per capire l’ importanza di questo elemento basta osservare la struttura molecolare della clorofilla. Il Mg è il “core” di questa molecola e una sua carenza significa per la pianta una riduzione della clorofilla e quindi della fotosintesi.
- Carenza: è subito intuibile che le carenze di questo elemento si manifestano con lo scolorimento delle lamine fogliari che diventano di un verde pallido con tendenza al giallo. Questa decolorazione procede dal margine fogliare verso l’ interno mentre le venature mantengono il loro colore verde. Questo fenomeno di clorosi è esattamente l’ opposto di quella che vediamo con una carenza di ferro e a lungo andare comporta un processo di necrosi dei tessuti sempre partendo dal margine fogliare. Poiché il Mg influenza insieme al calcio (Ca) il GH, quando questo è molto basso è facile che dipenda dal Mg visto che carenze di Ca sono difficili a vedersi.
- Eccesso: Non sono noti effetti da sovradosaggio di Mg fatto salvo un aumento del valore del GH.
Calcio (Ca) – La sua presenza in acqua condiziona fortemente il GH per cui difficilmente vedremo segni che caratterizzano la carenza di questo elemento se non per valori di durezza molto bassi (inferiori a 2 a °dGH).
- Carenza: Gli apici delle piante presentano foglie piccole e malformate, diciamo quasi accartocciate, perché a fronte di un tessuto fogliare ridotto le nervature restano normali. Altro segno potrebbe essere una decolorazione che riguarda sempre la parte terminale della pianta.
- Eccesso: E’ difficile osservare un eccesso di Ca in quanto avremmo valori di GH molto alti ma se ciò dovesse verificarsi gli effetti sono quelli riconducibili ad una carenza di Mg visto che alte concentrazioni di calcio possono interferire con l’ assorbimento del magnesio.
Ferro (Fe) – Questo elemento è il più importante tra i micro nutrienti in quanto gioca un ruolo essenziale nella formazione della clorofilla. Il Fe a differenza del Mg non rientra nella struttura molecolare della clorofilla ma è un donatore di elettroni nei processi chimici che portano alla formazione di questo pigmento fondamentale nella sintesi clorofilliana. Poiché le piante assumono ferro sotto forma di ione ferroso (Fe2+) facilmente ossidabile a ione ferrico (Fe3+) esso viene protetto attraverso l’ uso di chelanti, soprattutto EDTA. Questo complesso metallo-organico si mantiene stabile per valori di pH che non superano il 7,0. Di questo bisogna tenerne conto quando si fertilizza, quindi cercate di mantenere il pH del vostro acquario ad un valore debolmente acido. Fanno eccezioni quei fertilizzanti che oltre all’ EDTA utilizzano altri chelanti resistenti in ambiente alcalino come EDDHA.
- Carenza: come abbiamo già visto per il Mg la sua carenza rallenta la produzione di clorofilla ma a differenza della carenza da Mg la decolorazione della foglia (clorosi) riguarda solo il tessuto fogliare ma non coinvolge le venature. La sua carenza è visibile prima nelle piante a stelo a crescita rapida con un veloce viraggio dal verde al giallino. Le foglie colpite sono sempre quelle apicali mentre con il Mg che è un altro elemento mobile che la pianta sposta verso l’ apice vengono coinvolte prima le foglie basali. La carenza di Fe si manifesta anche attraverso la necrosi della lamina fogliare visibile soprattutto nelle piante appartenenti al genere microsorum (felci).
- Eccesso: Il Fe è l’ elemento che consente alle piante “ rosse” di mantenere il loro bel colore o di esaltarlo ulteriormente. E’ per questo che si fertilizza con concentrazioni più elevate rispetto alle piante verdi. Quando si fertilizza troppo anche le piante verdi possono iniziare ad assumere un colore aranciato sulle parti apicali e più esposte alla luce. Si tratta di un sistema di difesa della pianta verso la forte irradiazione
Zolfo (S) : Esso rientra sempre nel gruppo dei macroelementi.
- Carenza: considerato che diversi nutrienti vengono somministrati sotto forma di solfati (SO42-) è difficile osservare una sua carenza. Questa si manifesta con sintomi identici a quella provocata dall’ azoto che possiamo escludere facendo il test dei NO3–.
- Eccesso: Andare in eccesso di S non è difficile ma è sufficiente fare dei cambi parziali come consigliato in tutti i protocolli di fertilizzazione, PMDD compreso, per evitare che questo possa succedere. Le piante mostrano la loro intollerabilità ad un eccesso di zolfo con l’ appassimento e caduta delle foglie più giovani.
Manganese (Mn) – Questo microelemento è caratterizzato dal fatto di presentare diversi stati di ossidazione e quindi nei fertilizzanti spesso è complessato anch’ esso con un chelante. Il Mn svolge importanti e complessi ruoli nelle sintesi biochimiche che portano alla formazione di clorofilla, amminoacidi e nell’ assorbimento dell’ azoto.
- Carenza: per il suo ruolo nella formazione di clorofilla le piante mostrano una clorosi simile a quella dovuta da carenza di Mg, spesso si presenta sotto forma di macchie tondeggianti gialle ma a differenza del Mg i fenomeni necrotici colpiscono tutta la lamina fogliare quindi anche le venature.
- Eccesso : poiché il Mn inibisce l’ assorbimento del Fe il suo eccesso mostra gli stessi sintomi di clorosi. Una clorosi con test positivo al ferro conferma l’ eccesso di questo microelemento.
Rame (Cu) – Il Cu in acquariofilia è noto soprattutto come agente antialghe per la sua elevata tossicità che si può manifestare anche sugli animali. Tuttavia le piante hanno bisogno di questo micro nutriente utile per molti processi biologici anche se in quantità ridottissime.
- Carenza: E’ difficile trovare una carenza di Cu in acquario perché le quantità necessarie sono davvero bassissime e quindi la quantità introdotta come “inquinante” nei processi di produzione dei fertilizzanti e da altre fonti come il mangime sono più che sufficienti per le piante. Se mai dovesse esserci una carenza questa si manifesta sulle foglie più giovani perché il rame non viene mobilizzato dalla pianta. Le foglie tendono ad accartocciarsi su di esse.
- Eccesso: quantità di poco superiori a quelle richieste antagonizzano con l’ assorbimento del ferro e del manganese. Quantità maggiori comportano una degradazione della clorofilla e la rapida morte della pianta.
Molibdeno (Mo) – Questo micro nutriente viene fornito prevalentemente sotto forma di ione MnO42- . Esso è decisivo per l’ utilizzo dell’ azoto in quanto fa parte della nitrato reduttasi che permette la trasformazione dei nitrati in nitriti successivamente trasformati in ammonio per la sintesi di amminoacidi.
- Carenza : i sintomi ricordano in parte quelli da carenza di N, le foglie presentano macchie verde chiaro o giallastre.
- Eccesso : le quantità richieste sono talmente basse e il contenuto nei fertilizzanti talmente piccolo che è praticamente impossibile avere problemi legati ad un eccesso.
Zinco (Zn) – Si potrebbe scrivere un libro per elencare e spiegare tutti i processi biochimici in cui interviene lo Zn.
- Carenza: Qualunque sia il protocollo , compreso il PMDD, assistere agli effetti di una sua carenza è impossibile ma qualora dovesse verificarsi essa si manifesta con una clorosi senza necrosi dei tessuti.
- Eccesso: Impossibile arrivare ad un eccesso con qualsiasi protocollo di fertilizzazione anche se si dovesse commettere errori nei dosaggi.
Boro (B) – Questo microelemento interviene nella formazione della parete cellulare sia delle foglie che delle radici.
- Carenza: Comporta un ridotto assorbimento di Mg, Ca, K e PO43- con conseguenti effetti sulla crescita delle piante.
- Eccesso: Impossibile arrivare ad un eccesso con qualsiasi protocollo di fertilizzazione, compreso errori nei dosaggi.
Cloro (Cl) – Il cloro è un microelemento indispensabile per la crescita delle piante che lo assorbono come ione Cl– (cloruro) in quantità veramente bassa per cui se si superano in acqua le quantità necessarie il Cl può diventare tossico. Oltre ad intervenire in alcuni processi della fotosintesi esso regola l’apertura e chiusura degli stomi attraverso cui le piante assorbono i nutrienti.
- Carenza: non si verifica mai ma ammesso che succeda le piante manifesterebbero una clorosi delle venature.
- Eccesso: spesso gli acquari presentano un eccesso di ioni cloruro visto che è introdotto frequentemente come sotto prodotto dei fertilizzanti. L’ ottima tollerabilità delle piante a questo micro elemento non comporta la manifestazione di nessun sintomo.
E’ vietato copiare anche parzialmente questo articolo e relative immagini senza l’autorizzazione dell’autore e dello staff di acquariofili.
©www.acquariofili.com