About Kh
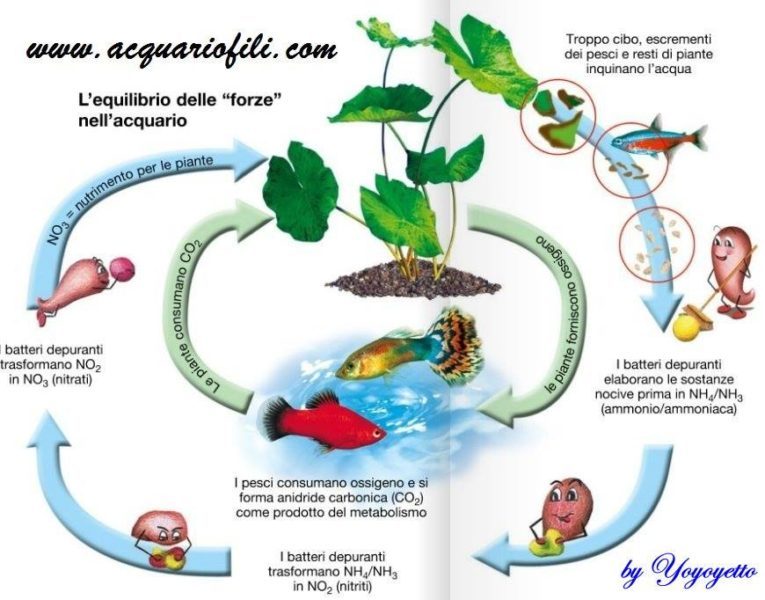
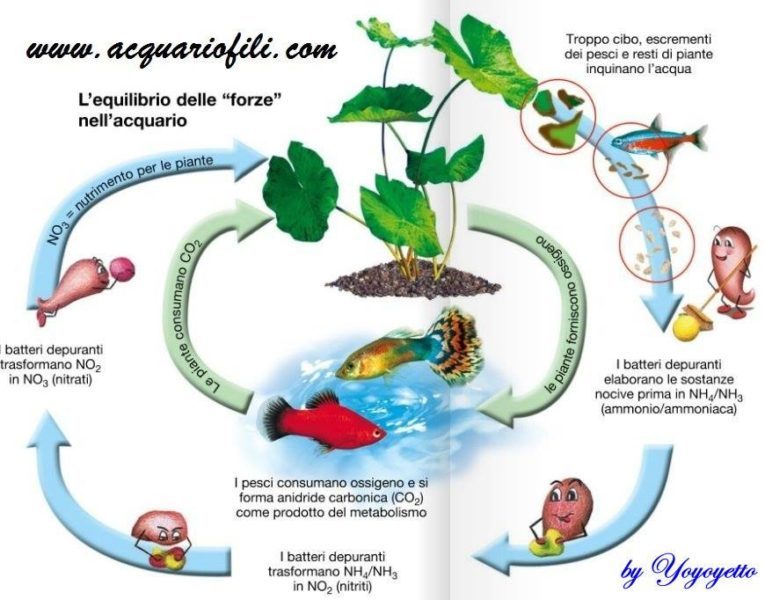
Nell’articolo relativo al GH (che puoi leggere cliccando QUI) è stato descritto il concetto di DUREZZA TOTALE. Abbiamo visto che quest’ultimo si compone di due diversi contributi: la durezza permanente e quella temporanea.
In questo articolo chiamato “About Kh” andremo ad analizzare un altro parametro molto importante per l’acquario correlato al concetto di durezza temporanea (ma non solo), ovvero il KH.

La DUREZZA TEMPORANEA esprime la concentrazione degli ioni dei metalli alcalino terrosi presenti in acqua, principalmente considerando gli ioni di Calcio e Magnesio (Ca2+ e Mg2+– in nero) in combinazione con lo ione bicarbonato (detto anche idrogencarbonato – HCO3–). Questo contributo alla durezza viene eliminato portando a ebollizione la soluzione, a causa della reazione:
Si forma ad esempio Carbonato di Calcio, che essendo poco solubile (a 25°C infatti la sua solubilità è di 13 mg in un litro di acqua!) precipita, formando un solido bianco.
Ma… tutto ciò come ha a che fare con il parametro del KH?
Il KH ci permette di misurare la DUREZZA CARBONATICA della soluzione. Cosa cambia rispetto alla durezza temporanea? Andiamo a considerare tutti i bicarbonati presenti in soluzione, non solo quelli legati a Calcio e Magnesio. Si considerano anche altri contributi, generalmente dati in maggior percentuale da Sodio e Potassio (Na+ e K+ – in blu). Per questa ragione in certe condizioni è possibile ottenere un valore di KH maggiore rispetto a quello del GH stesso.
La durezza carbonatica è correlata alla così detta ALCALINITA’ di una soluzione, ovvero la capacità di reagire con gli ioni H+, neutralizzandoli. Le principali reazioni che prendono parte a questo processo sono date:
- Dallo ione idrogeno carbonato (HCO3–): HCO–3+ H+ → H2CO3
- Dallo ione carbonato (CO32-): CO32-+ 2H+ → H2CO3
- Dallo ione idrossido (OH–): OH–+H+ → H2O
Andando però a osservare le condizioni della nostra vasca il contributo principale (quindi il composto che partecipa maggiormente alla regolazione degli equilibri all’interno dell’acquario) è il primo, gli altri sono presenti in quantità poco apprezzabili. Formalmente però, la definizione di alcalinità totale comprende anche il contributo di alcuni anioni acidi deboli (come solfuri, bisolfuri), silicati, fosfati e ammoniaca; ma il loro contributo è minimo.
[pullquote-left]Nota: Un’ulteriore precisazione è necessaria; infatti, quanto detto vale quando ci troviamo in assenza (o in presenza di quantità basse) di altre fonti di acidi deboli come acidi fulvici e umici. Essi sono abbondantemente presenti nei così detti acquari black water (o acque scure) o in vasche dove viene utilizzata torba. In questi casi la determinazione del KH, del pH per l’utilizzo delle tabelle per la regolazione della CO2 portano a dati “sfalsati” in quanto non si tiene conto del contributo dato da queste ultime fonti citate.[/pullquote-left]
A questo punto bisogna introdurre un nuovo concetto, ovvero quello di soluzione TAMPONE. L’alcalinità è indice della capacità tampone dell’acqua. Semplificando è la capacità di una soluzione di resistere a cambiamenti repentini del pH (entro certi limiti) causati dall’aggiunta di piccole quantità di sostanze acide o basiche, che potrebbero andare a modificarlo. Questo argomento viene trattato con maggiore dettaglio nell’articolo relativo al pH (trovate qui il link).
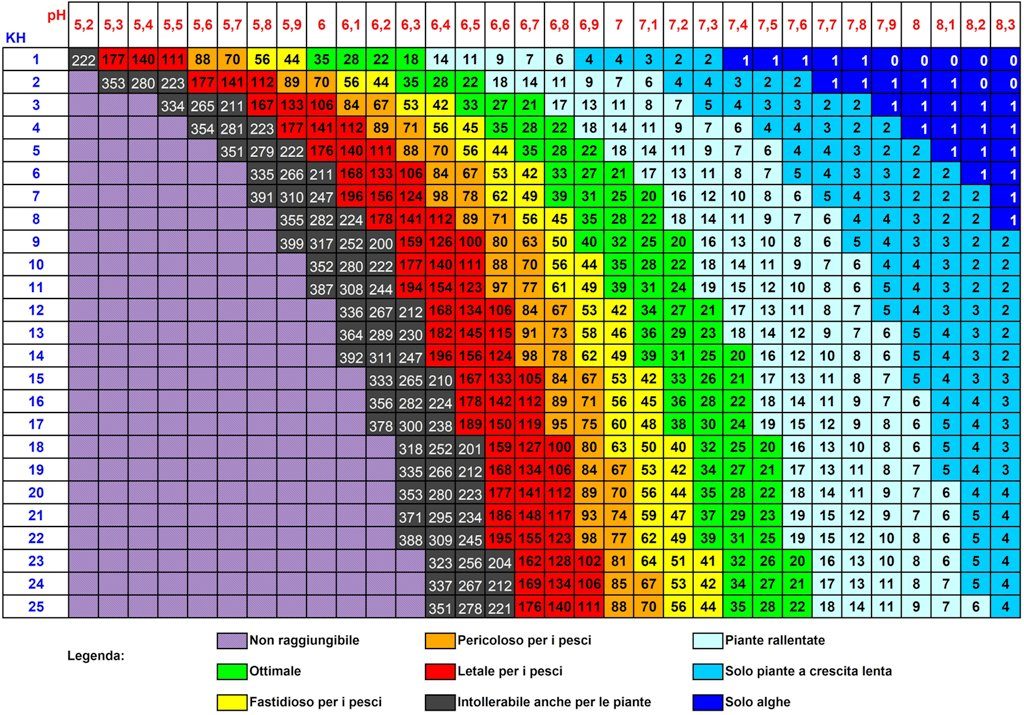
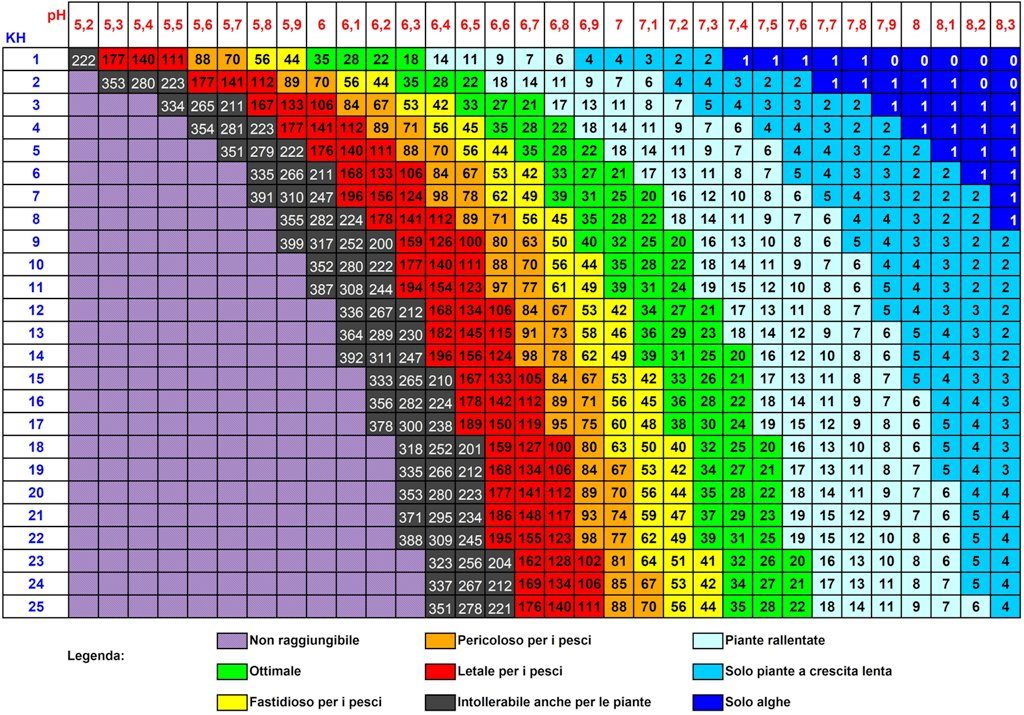
Tornando a quanto succede nelle nostre vasche, per ottenere un effetto tampone sufficiente (specialmente in presenza di erogazione di CO2) si consiglia di mantenere un valore del KH ≥3. Questo non implica che non esistano casi in cui si possa mantenere un KH inferiore (esistono vasche il cui valore di KH è 0, ma sono comunque stabili).
Nota: Bisogna porre attenzione sui terreni allofani. Questi terreni sono caratterizzati da un elevato CSC (acronimo di capacità di scambio cationico). Essi hanno la capacità di attirare e legare elettrostaticamente tutti i cationi (ioni a carica positiva) presenti in acqua. Quando le radici assorbono i cationi rilasciano ioni idrogeno (H+) che si fissano al terreno allofano, il quale, a sua volta, li libera in acqua per legare a se altri cationi. Gli ioni idrogeno liberati vanno ad abbassare il pH e questo spiega la capacità di questo fondo di acidificare l’acqua. Inoltre, gli ioni idrogeno liberati interagiscono con i bicarbonati presenti in acqua tramite la seguente reazione:
H++HCO–3 → H2CO3
Che a sua volta dà la reazione:
H2CO3 → H2O+CO2
La CO2, in qualità di gas, tende ad abbandonare l‘acqua (esattamente il contrario di quello che succede quando usiamo la CO2).
Riassumendo… Alla fine di tutto ciò cosa succede? Il KH si abbassa e con esso anche il pH. Questo spiega la gestione più complessa dei fondi allofani soprattutto quelli più reattivi come quelli neri. Spesso in questo tipo di allestimenti si utilizzano rocce contenenti carbonati (come le Seiryu Stone), in modo da controbilanciare l’effetto del fondo stesso e ridurre l’abbassamento del KH stesso. In aggiunta solitamente durante il primo periodo vengono svolti piccoli cambi periodici per inserire nuovamente carbonati e chiaramente ciò comporta dei periodi di maturazione più lunghi. Ovviamente questo effetto non dura per sempre, ma termina una volta raggiunto il livello di saturazione. È difficile stimare la durata del fenomeno, in quanto è strettamente correlata al tipo di acqua che stiamo utilizzando e al valore del suo KH.
Un’altra cosa importante da considerare, quando stiamo allestendo o gestendo una vasca, è l’eventuale presenza di un addolcitore domestico. Questo genere di impianti permette di ridurre la durezza dell’acqua di rete scambiando gli ioni Ca2+ e Mg2+ (formano carbonati poco solubili che possono depositarsi all’interno dei tubi e negli elettrodomestici, compromettendone il funzionamento e riducendone di fatto la durata) con ioni Na+ (il sodio forma dei carbonati molto solubili riducendo il fenomeno prima descritto). Quantità eccessive di sodio, però, tendono a creare problemi alla fisiologia piante già a basse concentrazioni (dipendenti chiaramente dal tipo di pianta, ma in genere si considera come limite di riferimento 40 mg/L). Motivo per cui, l’acqua di rete in questo caso va assolutamente evitata.
Nota: Quando analizziamo le acque di rete e troviamo il KH maggiore del GH dobbiamo porre molta attenzione all’ uso di questa acqua perché quasi sempre è ricca di sodio. Il Mg deriva generalmente più dai solfati che dai carbonati/bicarbonati mentre i sali di potassio sono sempre scarsissimi o nulli nelle nostre acque per una questione di conformazione geologica.
Come possiamo misurare il KH?
La determinazione di questo parametro è piuttosto semplice; basta infatti munirsi di relativo test a reagente. Esso sfrutta una reazione chimica grazie alla quale si noterà un cambiamento cromatico dall’azzurro a giallo brillante all’interno della provetta stessa, una volta raggiunto il valore effettivo del KH. Contando semplicemente il numero delle gocce utilizzate otterremo quindi il valore numerico del KH.
Sconsiglio l’utilizzo di test a strisce in quanto danno un valore non puntuale, ma un’indicazione sul range, che personalmente trovo poco utile.
Ma… cosa ci dice il valore che abbiamo ottenuto?
Il valore ottenuto esprime la durezza in gradi tedeschi, ovvero:

In pratica andremo a trasformare tutti i contributi alla durezza considerandoli come dovuti solo dai composti a base di Calcio, più esattamente a base di CaO.
[pullquote-right]Nota: non è possibile ricavare tale valore da una misura di conduttività, in quanto quest’ultimo viene ottenuto sommando il contributo di tutti gli ioni disciolti in acqua. Ovviamente, però, la sua eventuale modifica porterà a una modifica nel valore di conduttività.[/pullquote-right]
Spesso si leggono richieste di chiarimento in merito a un aumento del KH (a volte accompagnato anche da un aumento di GH) tra un cambio di acqua e il successivo. In genere le cause principali vanno ricercate:
- Nella modalità in cui vengono fatti i rabbocchi di acqua evaporata. L’utilizzo di acqua RO (di buona qualità) non crea modifiche né nel KH né nel GH quando viene usata nei rabbocchi, mentre l’uso di acqua di rubinetto o di acqua RO di bassa qualità, aggiungendo sali in vasca crea un aumento nei valori delle durezze (il dettaglio viene spiegato in un articolo apposito, il cui link si trova nel prossimo paragrafo).
- Nella presenza di arredi o fondo calcareo, che soprattutto in presenza di pH debolmente acidi, tendono a rilasciare in vasca i carbonati che li compongono, alterando il KH. Per evitare di inserire materiali di questo tipo è sufficiente testarli con qualche goccia di viakal o acido muriatico; se si sviluppano delle bollicine (e “il materiale frigge”) siamo in presenza di materiale calcareo. Personalmente ne sconsiglio l’uso, salvo in particolari allestimenti come quelli dei grani laghi africani (Malawi e Tanganika).
Come possiamo modificare il KH?
Per prima cosa quando andiamo a modificare il valore del KH dobbiamo ricordarci che potremmo avere ripercussioni anche sul valore del pH. Per questo motivo bisogna agire lentamente su questo parametro evitando variazioni superiori a 2° dH, in quanto non è la variazione di KH in sè che può creare problematiche agli abitanti della vasca, ma l’oscillazione del pH ad essa associata (se eccessiva può anche risultare mortale).
Per ABBASSARE il KH possiamo quindi ricorrere all’uso di acqua di osmosi (RO = reverse osmosis). Essa infatti è caratterizzata da un valore di GH e KH pari a 0 (se di buona qualità) e grazie a piccoli cambi eventualmente ravvicinati, ci permetterà di ottenere il valore desiderato. Si consigliano piccoli cambi di acqua RO, se usata pura (tra il 5-10%, ma non oltre il 20%) ogni 3-4 giorni, per evitare shock osmotici.
Nota: l’acqua di osmosi RO ABBASSA TUTTI i valori, non solo il KH, perché noi andiamo ad effettuare una diluizione ovvero un abbassamento della concentrazione di tutti i sali disciolti in acqua per cui successivamente dovremo operare una correzione sull’ altro parametro che caratterizza la durezza, il GH. Cliccando sul seguente link si aprirà una scheda specifica su come operare i cambi parziali e come calcolare la quantità di RO da utilizzare per ottenere un determinato abbassamento.
Per ALZARE il KH ci sono diverse strade:
- Utilizzare acqua avente KH superiore a quello della vasca durante i cambi.
- Utilizzare sali commerciali appositi (già bilanciati) in base alle proprie esigenze. Questa strada va seguita anche nel momento in cui si opta per una gestione con sola acqua di osmosi. Questa andrà ricostruita per ottenere i parametri di KH e GH desiderati (agendo singolarmente o su entrambi in contemporanea).
- Utilizzare una soluzione a base Bicarbonato di Potassio (KHCO3). Nella preparazione va necessariamente usata acqua RO. Sconsiglio l’uso del Bicarbonato di Sodio (Na2CO3), che benchè sia più economico, inserisce una quantità di Na+ non idonea per le vasche di acqua dolce.
Se intendete utilizzare il rimedio casalingo dell’osso di seppia, tenete presente che si avrà una variazione anche sul GH.
In conclusione: About Kh è una guida scritta utilizzando un linguaggio semplice in modo da essere facilmente comprensibile e quindi trasmettere concetti relativi alla chimica dell’ acquario, altre guide simili ad About Kh stanno per essere pubblicate sul nostro portale in modo da avere un punto di riferimento per consultazioni piu’ rapide.
E’ vietato copiare anche parzialmente questo articolo About Ph e relative immagini senza l’autorizzazione dello staff di acquariofili e del proprietario.
Guida About Kh impaginata da Marco Ferrara
©www.acquariofili.com