La micropropagazione è una alternativa ai metodi convenzionali di propagazione delle piante che consiste nella produzione di piante da piccole parti di esse, fatte crescere in contenitori dove vengono controllati l’ambiente e la nutrizione. Le piante che ne risultano sono identiche da un punto di vista genetico.
I vantaggi della propagazione in vitro sono: la possibilità di produrre un gran numero di piante da una singola pianta “madre” e in poco tempo (sempre relativo alla specie) e la possibilità di ottenere piante libere da virus. Quest’ultima caratteristica è molto importante per quanto riguarda le piante di interesse agricolo. Di contro però le piante che si ottengono sono geneticamente tutte uguali e quindi sono tutte suscettibili allo stesso modo all’ambiente e alle infezioni (se la pianta da cui si parte per caso ha una mutazione, porteremo questa mutazione a tutte le piante ottenute in vitro).
In questo articolo si spiegano le principali caratteristiche di questa metodica, in modo tale da poterla sviluppare in un ambiente non del tutto scientifico, tenendo conto che sicuramente i risultati non saranno minimamente paragonabili a quelli che si ottengono in un laboratorio. Pur essendo la metodica abbastanza semplice (forse maggiormente per chi ha lavorato in un laboratorio) il vero problema della micropropagazione in vitro è il mantenere tutto sterile, dalla porzione di pianta che si utilizza, ai terreni di coltura, alla strumentazione, all’ambiente. Inoltre per ogni specie di pianta che vogliamo propagare ci sono innumerevoli variabili a partire dalla composizione del mezzo di coltura, alla temperatura, all’illuminazione. Addirittura alcune piante hanno bisogno di buio completo per iniziare a formarsi. In realtà si possono ulteriormente semplificare i passaggi utilizzandi materiale e attrezzature fornite da ditte specializzate, ma naturalmente con dei costi non indifferenti.
Per creare un piccolo laboratorio, relativamente casalingo, occorre:
- una camera sterile: si può usare anche un acquario non troppo alto. Le dimensioni dovrebbero essere: 50cm (lunghezza), 40 cm (altezza) e 40 cm (profondità)
- Una pentola a pressione per sterilizzare i terreni, gli strumenti, l’acqua, la carta, etc;
- Vasetti di vetro (ad esempio i vasetti degli omogeneizzati) e contenitori di vetro che possano essere messi nella pentola a pressione;
- Forbicine, pinzette, ecc…;
- Carta assorbente o fogli A4 per fotocopie che possono essere sterilizzati e utilizzati come base di taglio;
- Una lampada a spirito per fiammeggiare gli strumenti;
- Un contenitore spray contenente alcool al 70% (quello che si usa per i liquori va bene) per spruzzare la camera sterile e altre superfici;
- Una soluzione di 1:4 di candeggina per disinfettare le superfici e il materiale vegetale;
- Un disinfettate cutaneo;
- Terreni di coltura.
Il terreno di coltura è un mezzo liquido, semiliquido o solido che permette alle cellule o a pezzi di tessuto di vivere in vitro; di solito contiene tutta una serie di sostanze specifiche per le cellule che utilizziamo.
Il terreno di coltura deve essere sostituito spesso perchè man mano che le cellule crescono e si riproducono lo impoveriscono delle sostanze nutrienti. Inoltre si possono aggiungere ormoni per favorire e velocizzare alcuni processi particolari, nel nostro caso ad esempio la radicazione delle plantule.
Per preparare un terreno di coltura adatto si possono utilizzare materiali che possono essere reperiti nei supermercati, rivenditori di prodotti chimici, etc.:
- due bicchieri di acqua piovana (o quella di osmosi);
- un quarto di bicchiere di zucchero;
- mezza tavoletta di fertilizzante che contenga in queste proporzioni 10:10:10 di N:P:K in 1 litro di acqua;
- Mezza tavoletta di inositolo (500mg);
- Mezza tavoletta di vitamine con tiamina (si può usare una compressa multivitaminica);
- Agar
Nelle Tabelle 1 e 2 sono indicate le concentrazioni di un mezzo di coltura normalmente utilizzato in laboratorio. La seconda tabella si riferisce al terreno di coltura per la patata dolce americana (Batata), ma è utile per capire quali componenti comunque sono necessari: a seconda delle specie che ci interessa cambiano le concentrazioni ma le sostanze organiche sono sempre le stesse. In particolare, NAA e BAP sono degli ormoni stimolanti: NAA o acido 1-naftilacetico o alfa-naftalenacetico è uno stimolante della radicazione di talee, BAP è un fitostimolatore della fase vegetativa. Inoltre si può aggiungere IAA, o auxina, (0.1 mg/l)) che è un ormone regolatore della crescita delle piante nonchè della radicazione.
Tabella 1: Composizione della soluzione salina di base secondo Murashige and Skoog (1962)
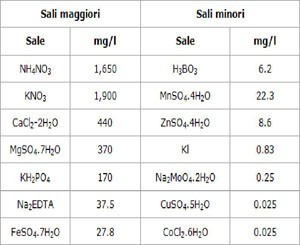
Tabella 2: Additivi organici in un mezzo di coltura per la patata dolce
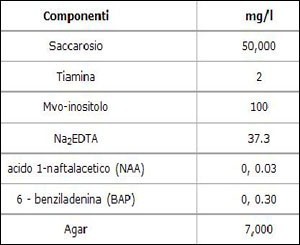
Quello preparato sopra è il terreno di base per iniziare a formare i calli cellulari.
Per la preparazione del terreno di moltiplicazione o il terreno di radicamento si aggiunge mezzo bicchiere di latte di cocco e mezza tavoletta di malto. Il latte di cocco può essere sostituito con mezzo bicchiere di polpa di pomodoro verde, o mezzo bicchiere di succo di arancia fresco.
Però ognuno di questi ingredienti può dare risposte diverse e deve essere verificato per il tipo di pianta che vogliamo fare crescere.
Il pH del terreno deve essere compreso fra 5 e 6; se diverso può essere rettificato con acido citrico o bicarbonato di sodio. Si mescolano gli ingredienti e si scaldano fino a sciogliere l’agar. Quando la soluzione si sta raffreddando ma l’agar è ancora in fase liquida si versa il terreno nei vasetti di vetro fino a formare uno spessore di circa 2 cm. Si chiude il tutto e si mette nella pentola a pressione. Quando la valvola della pentola fischia si lasciano nella pentola per 15 minuti.
Le forbicine, gli scalpellini, le pinzette, prima di iniziare il lavoro, devono essere lavati e risciacquati accuratamente per eliminare ogni residuo di detergente, infine devono essere sterilizzati nella pentola a pressione. Durante il lavoro possono essere sterilizzati con la soluzione di candeggina e fiammati. Per sterilizzare la carta si mette in un supporto non coperto dall’acqua nella pentola a pressione e si sterilizza sempre per 15 minuti.
Il materiale vegetale può essere sterilizzato in una soluzione diluita di candeggina: 1/4 di candeggina + 1/4 di acqua + una goccia di detergente che agisce da surfattante, cioè riduce la tensione superficiale e stabilizza la sospensione. Si mettono i pezzi di pianta in un vasetto contenente la soluzione per 10-20 minuti. Si agita e si butta la soluzione di candeggina. Si sciacquano i pezzi con acqua sterile.
Il punto essenziale della micropropagazione è che le colture devono essere libere da ogni contaminazione: batterica, virale e fungina. Ci sono perciò alcune regole da seguire, alcune possono sembrare banali, ma in realtà aiutano ad evitare anche contaminazioni accidentali.
- Tirare indietro i capelli e le maniche e rimuovere anelli e braccialetti. Lavarsi le mani con una soluzione disinfettante, altrimenti mettersi dei guanti da laboratorio usa e getta e pulirli con l’alcol al 70%.
- Sterilizzare la cabina sterile (l’acquario) con una soluzione al 70% di alcool e asciugare con tessuto sterile.
- Riporre tutta la strumentazione necessaria nella cabina sterile dopo averla sterilizzata.
- Il materiale vegetale non deve essere mai toccato con le mani ma sempre con le pinzette sterilizzate.
- Ogni volta che si utilizza uno strumento va sterilizzato con alcool o la soluzione di candeggina e fiammato se possibile.
I piccoli pezzi di pianta (Fig.1), di lunghezza di circa 2-3 cm, vengono tagliati e posti nel terreno di base già sterilizzato. I pezzi inseriti nel terreno devono stare a temperatura ambiente sotto la luce diretta e con il contenitore chiuso. I pezzi da prelevare possono derivare da apici del germoglio, pezzi di foglie, pezzi a ridosso degli internodi, pezzi di radice.
Fig.1: piccole parti di foglia appena sezionate e pronte per essere messe nel mezzo di coltura
Non ci si deve certo aspettare che tutti i contenitori diano risultati soddisfacenti: alcuni pezzi di pianta possono essere uccisi o danneggiati dalla soluzione di candeggina, o uccisi dalle tossine prodotte dalle stesse piante, oppure possono contaminarsi con funghi e batteri (Fig.2). Queste colture danneggiate o infette vanno eliminate.

Fig.2: colture vegetali contaminate
Una volta che il germoglio si è formato (fig.3), si può trasferire nel mezzo di coltura per il radicamento, quello contenente latte di cocco e malto (fig.4)

Fig.3: accrescimento della piantina fino alla radicazione

Fig.4: plantula radicata
Le radici di solito si formano in 2-4 settimane. Una volta che si sono formate le radici si passa all’acclimatazione. Si rimuovono le plantule radicate dall’agar con una forbicina e si lava via l’agar con acqua tiepida. Si invasano le plantule in terriccio misto (senza fertilizzanti) umido.
Dopo questa operazione si spruzzano le piante con acqua. I vasetti vanno posti in contenitori di vetro o plastica trasparente chiusi posti sotto il sole in modo da aumentare l’umidità interna. Quando le piante cominciano a crescere e sono acclimatate si possono utilizzare.
Questa metodica che può sembrare molto semplice in realtà comporta una buona manualità, non tanto per il trasferimento delle piante o parti di esse nei vari passaggi quanto per il mantenere tutto l’ambiente di lavoro (la camera sterile e gli strumenti) sempre puliti. I pezzi di pianta e i calli che si producono da essa sono infatti altamente suscettibili ad infezioni perchè non hanno alcun tipo di difesa e inoltre i terreni di coltura così ricchi di sostanze favoriscono la crescita di batteri e funghi. In realtà nei laboratori si aggiungono ai terreni alcuni antibiotici (streptomicina, penicillina) e l’amfotericina B per i funghi, per avere una maggiore probabilità di successo.








